La enfermedad de Graves es una enfermedad autoinmune caracterizada por un aumento global del tamaño de la glándula tiroidea (bocio) y por hiperfunción tiroidea.
Síntomas físicos frecuentes son ojos rojos, secos, hinchados, grandes y protuberantes (exoftalmos); intolerancia al calor, problemas de sueño y ansiedad. No obstante, el signo más común de la enfermedad de Graves es el bocio o aumento del tamaño de la tiroides. El exceso de hormonas tiroideas puede llegar a provocar un grave desequilibrio metabólico, la tirotoxicosis.
Fisiopatología
Habitualmente los pacientes tienen antecedentes familiares de varias enfermedades tiroideas autoinmunes, como enfermedad de Graves, tiroiditis de Hashimoto o tiroiditis posparto. En
la enfermedad de Graves, el propio receptor de TSH es el autoantígeno principal, y el responsable del hipertiroidismo.
La glándula tiroidea está siendo constantemente estimulada por los autoanticuerpos circulantes que se unen al receptor de TSH, y la secreción hipofisaria de TSH está suprimida por la elevada producción de hormonas tiroideas. Estos anticuerpos estimulantes de la tiroides provocan la liberación de hormonas tiroideas y Tg, y también estimulan la captación de yodo, la síntesis de proteínas y el aumento de tamaño de la glándula tiroidea.
DESENCADENANTES
*genética
* estrés
Tratamiento médico
En pacientes con hipotiroidismo mantenido, como la enfermedad de Graves o el bocio multinodular tóxico, se utilizan medicamentos antitiroideos. El objetivo de estos fármacos es impedir que la tiroides produzca hormonas.
viernes, 21 de septiembre de 2018
SÍNDROME METABÓLICO
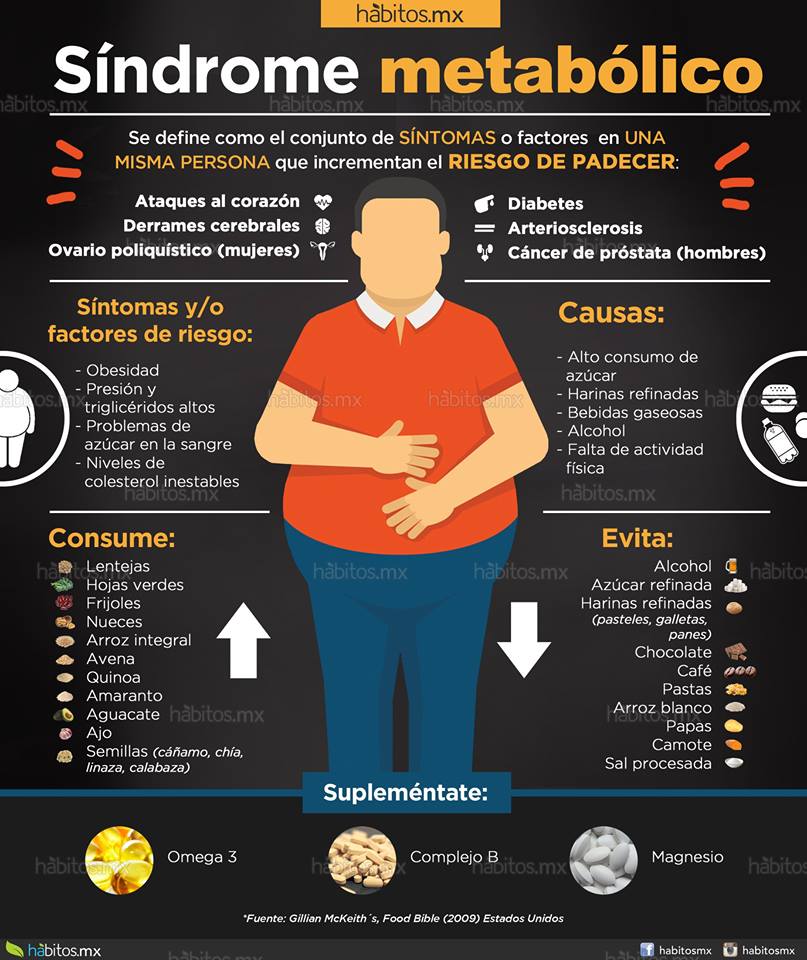
El síndrome metabólico (SM) es un conjunto de anormalidades metabólicas consideradas como un factor de riesgo para desarrollar enfermedad cardiovascular y diabetes.
Se ha descrito a la insulinorresistencia como el pilar para el desarrollo de las alteraciones que conforman el mismo, como son el aumento de la presión arterial, elevación de la glicemia de
ayunas, aumento de triglicéridos, disminución del colesterol HDL, así como
una condición de obesidad abdominal.
La relación entre obesidad abdominal e insulinorresistencia ha sugerido a la primera como origen o factor desencadenante del síndrome. Nos referimos a la obesidad abdominal u obesidad central como un incremento del perímetro abdominal, lo cual representa una medida indirecta del aumento de grasa visceral.
Los criterios diagnósticos propuestos para síndrome metabólico son diversos.
Desde el año 1988, en que el Dr. Gerald Reaven describe el síndrome como una serie de normalidades que incluye hipertensión arterial, diabetes mellitus y dislipidemia, denominándolo
‘síndrome X’, donde la resistencia a insulina constituía el factor o principal mecanismo fisiopatológico, se han publicado diferentes artículos y guías respecto al diagnóstico, prevención y
tratamiento del síndrome. La Organización Mundial de la Salud (OMS), International Diabetes Federation (IDF), National Cholesterol Education Program Adult Treatment Panel III (ATP III) y la
American Association of Clinical Endocrinologists (AACE) han propuesto sus criterios diagnósticos o componentes del síndrome metabólico.
Los criterios para el diagnóstico de síndrome metabólico según las recomendaciones
de las guías de ALAD 2010 son:
• Obesidad abdominal: perímetro de cintura mayor o igual a 94 cm en varones
y 88 cm en mujeres.
• Triglicéridos altos: mayores a 150 mg/dL (o en tratamiento hipolipemiante
específico).
• Colesterol HDL bajo: menor de 40 mg% en hombres o menor de 50 mg% en mujeres (o en tratamiento con efecto sobre el HDL).
• Presión arterial elevada: presión arterial sistólica (PAS) mayor o igual a 130 mmHg y/o PAD mayor o igual a 85 mmHg.
• Alteración en la regulación de glucosa: glucosa anormal en ayunas, intolerancia a la glucosa o diabetes.
La evaluación correcta de cada componente del SM nos llevará a buen diagnóstico y a detectar personas de riesgo alto que pudieran no estar siendo consideradas como tal, siendo tratadas por factores de riesgo individuales.
Las siguientes son sugerencias para una buena evaluación:
• Evaluación del perímetro abdominal: debe realizarse con el paciente en posición de pie al final de una espiración normal, con los brazos relajados a cada lado. La medida debe tomarse a la altura de la línea media axilar, en el punto imaginario que se encuentra entre la parte inferior de la última costilla y el punto más alto de la cresta iliaca (principal punto de referencia).
• Determinación de glicemia en ayunas: debe realizarse con por lo menos ocho horas previas de ayuno y en las primeras horas de la mañana, pues sabemos que fisiológicamente nuestro organismo tendrá una respuesta hepática compensatoria si no ingerimos alimentos y la mediciónno será exacta. De igual forma, fisiológicamente tendremos una concentración de glucosa elevada para nuestra referencia si no guardamos el ayuno respectivo, mostrando los resultados valores posprandiales,
para los cuales las referencias aceptadas son diferentes.
• Medición de la presión arterial: debe realizarse cuando la persona esté descansada y tranquila. No
debe tomarse después del ejercicio o si la persona se siente estresada. Recordemos que no estamos diagnosticando hipertensión arterial. Por tanto, nuestro objetivo debe ser claro respecto al valor de referencia (130/85 mmHg) para el diagnóstico de SM. La medición podemos realizarla usando un monitor digital para presión arterial o un esfigmomanómetro y estetoscopio. La medición va a ser correcta en ambos casos si realizamos el procedimiento de manera adecuada. Podemos utilizar la “Recomendaciones de la American Heart Association para la toma de la presión arterial”, publicado en la revista Circulation de febrero del año 2005.
Se ha descrito a la insulinorresistencia como el pilar para el desarrollo de las alteraciones que conforman el mismo, como son el aumento de la presión arterial, elevación de la glicemia de
ayunas, aumento de triglicéridos, disminución del colesterol HDL, así como
una condición de obesidad abdominal.
La relación entre obesidad abdominal e insulinorresistencia ha sugerido a la primera como origen o factor desencadenante del síndrome. Nos referimos a la obesidad abdominal u obesidad central como un incremento del perímetro abdominal, lo cual representa una medida indirecta del aumento de grasa visceral.
Los criterios diagnósticos propuestos para síndrome metabólico son diversos.
Desde el año 1988, en que el Dr. Gerald Reaven describe el síndrome como una serie de normalidades que incluye hipertensión arterial, diabetes mellitus y dislipidemia, denominándolo
‘síndrome X’, donde la resistencia a insulina constituía el factor o principal mecanismo fisiopatológico, se han publicado diferentes artículos y guías respecto al diagnóstico, prevención y
tratamiento del síndrome. La Organización Mundial de la Salud (OMS), International Diabetes Federation (IDF), National Cholesterol Education Program Adult Treatment Panel III (ATP III) y la
American Association of Clinical Endocrinologists (AACE) han propuesto sus criterios diagnósticos o componentes del síndrome metabólico.
Los criterios para el diagnóstico de síndrome metabólico según las recomendaciones
de las guías de ALAD 2010 son:
• Obesidad abdominal: perímetro de cintura mayor o igual a 94 cm en varones
y 88 cm en mujeres.
• Triglicéridos altos: mayores a 150 mg/dL (o en tratamiento hipolipemiante
específico).
• Colesterol HDL bajo: menor de 40 mg% en hombres o menor de 50 mg% en mujeres (o en tratamiento con efecto sobre el HDL).
• Presión arterial elevada: presión arterial sistólica (PAS) mayor o igual a 130 mmHg y/o PAD mayor o igual a 85 mmHg.
• Alteración en la regulación de glucosa: glucosa anormal en ayunas, intolerancia a la glucosa o diabetes.
La evaluación correcta de cada componente del SM nos llevará a buen diagnóstico y a detectar personas de riesgo alto que pudieran no estar siendo consideradas como tal, siendo tratadas por factores de riesgo individuales.
Las siguientes son sugerencias para una buena evaluación:
• Evaluación del perímetro abdominal: debe realizarse con el paciente en posición de pie al final de una espiración normal, con los brazos relajados a cada lado. La medida debe tomarse a la altura de la línea media axilar, en el punto imaginario que se encuentra entre la parte inferior de la última costilla y el punto más alto de la cresta iliaca (principal punto de referencia).
• Determinación de glicemia en ayunas: debe realizarse con por lo menos ocho horas previas de ayuno y en las primeras horas de la mañana, pues sabemos que fisiológicamente nuestro organismo tendrá una respuesta hepática compensatoria si no ingerimos alimentos y la mediciónno será exacta. De igual forma, fisiológicamente tendremos una concentración de glucosa elevada para nuestra referencia si no guardamos el ayuno respectivo, mostrando los resultados valores posprandiales,
para los cuales las referencias aceptadas son diferentes.
- Determinación de triglicéridos y de colesterol HDL: también debe realizarse con por lo menos ocho horas previas de ayuno y en las primeras horas de la mañana. La concentración de triglicéridos puede variar según lo descrito para glucosa, no así el valor de HDL. Sin embargo, se recomienda que la medición de ambos sea en ayunas .
• Medición de la presión arterial: debe realizarse cuando la persona esté descansada y tranquila. No
debe tomarse después del ejercicio o si la persona se siente estresada. Recordemos que no estamos diagnosticando hipertensión arterial. Por tanto, nuestro objetivo debe ser claro respecto al valor de referencia (130/85 mmHg) para el diagnóstico de SM. La medición podemos realizarla usando un monitor digital para presión arterial o un esfigmomanómetro y estetoscopio. La medición va a ser correcta en ambos casos si realizamos el procedimiento de manera adecuada. Podemos utilizar la “Recomendaciones de la American Heart Association para la toma de la presión arterial”, publicado en la revista Circulation de febrero del año 2005.
CLIMATERIO Y MENOPAUSIA
La menopausia natural es un evento fisiológico definido como el último periodo menstrual. Representa el cese permanente de las menstruaciones debido a la pérdida de la función ovárica ocasionada por la edad. La menopausia natural o espontánea se identifica en forma retrospectiva
una vez que han transcurrido 12 meses de amenorrea, ya que no existen otros marcadores específicos
para establecer el diagnóstico en forma más temprana y precisa. La menopausia inducida es la que se origina por extirpación quirúrgica de los ovarios, por radiaciones o medicamentos citotóxicos. Cuando la menopausia aparece antes de los 40 años de edad se le denomina menopausia prematura, y cuando es entre los 40 y los 45 años, se conoce como menopausia temprana.
A la situación caracterizada por amenorrea temporal (mayor a cuatro meses) e incremento de las gonadotropinas hipofisarias en mujeres menores de 40 años de edad se denomina insuficiencia ovárica primaria.
El climaterio corresponde al periodo de transición de la etapa reproductiva a la no reproductiva y comprende toda la transición menopáusica y una fracción no determinada de la posmenopausia.
ETIOLOGÍA
La menopausia natural parece estar determinada por los genes, pero los mecanismos que regulan no se han esclarecido por completo. De los diversos factores que se han investigado como posibles modificadores de la edad de aparición de la menopausia, sólo el tabaquismo se ha asociado
de manera consistente con su manifestación más temprana, adelantándola en dos o tres años.
Menopausia natural
En general, se acepta que la depleción de folículos es el evento principal de la senescencia ovárica, aunque no se descarta que mecanismos centrales puedan participar en el inicio de los cambios que ocurren en el nivel de la gónada. Para comprender mejor este proceso es necesario revisarlo a partir de las condiciones que la función ovárica tiene en la etapa reproductiva.
CUADRO CLÍNICO
Aunque la menopausia es un fenómeno natural, con las fluctuaciones de las hormonas ováricas e hipofisarias, en especial la disminución de estradiol, algunas mujeres pueden manifestar diversos síntomas que inciden sobre todo, aunque no de manera exclusiva, durante la transición menopáusica tardía y la posmenopausia temprana.
El tipo y número de síntomas descritos varían con amplitud, pero mediante análisis factorial se ha demostrado que, por lo general, corresponden a tres grandes grupos o factores: vasomotor, psicológico y somático. Sólo los síntomas vasomotores y la atrofia vulvovaginal están relacionados
con claridad con la menopausia.
SÍNTOMAS VASOMOTORES
Están constituidos por bochornos y sudoraciones nocturnas.
Los bochornos son oleadas súbitas de calor acompañadas de sudoración, localizadas sobre todo en cuello y cara, cuya duración es de minutos. Las sudoraciones nocturnas son el equivalente de los bochornos, durante el sueño. Se piensa que los bochornos se originan por disrupción de los mecanismos reguladores de la temperatura en el nivel central, cuya causa principal, pero no exclusiva, es la disminución de estrógenos.
ALTERACIONES SOMÁTICAS
Este grupo comprende síntomas muy diversos, siendo los más frecuentes mareos, tensión muscular, entumecimiento de extremidades, disestesias, parestesias, cefalea, artralgias y mialgias. Su relación con la deprivación de estrógenos tampoco es evidente y quizá por eso los efectos del tratamiento hormonal no han sido mejores a los de diferentes placebos.
SÍNTOMAS GENITOURINARIOS
La atrofia de los epitelios vaginal y urinario es consecuencia directa de la falta de estrógenos. Sus manifestaciones clínicas son sequedad vaginal, dispareunia, mayor susceptibilidad a infecciones vaginales e incontinencia urinaria (de esfuerzo y mixta), así como alteraciones de la estática pélvica (distopias genitales), como prolapso uterino, vesical y rectal, que por lo general se asocian con
relajamiento de la musculatura del piso pélvico. Muchas mujeres tienen estos síntomas con mayor intensidad durante la posmenopausia, pero con la administración local de estrógenos o lubricantes no hormonales es posible obtener mejoría importante en la mayor parte de los casos.
TRATAMIENTO
La base de la atención a la mujer en la peri y posmenopausia es la medicina preventiva. Las acciones deben encaminarse a informar acerca de la naturaleza de los eventos que aparecen a lo largo del envejecimiento ovárico, así como a promover cambios en el estilo de vida con la adopción de medidas higiénico-dietéticas que incluyen una dieta balanceada, aporte suficiente de calcio y
vitamina D, ejercicio y eliminación del sobrepeso, entre otras. La eliminación del tabaquismo, reducción en la ingesta de alimentos picantes o irritantes y de bebidas calientes; la disminución en la temperatura ambiental y tensión emocional han demostrado ser útiles para reducir los síntomas vasomotores.
La prevención de las enfermedades cardiovasculares de la mujer debe procurarse con las medidas generales que aplican a los hombres y no mediante la administración de terapia hormonal sistémica.
TRATAMIENTO FARMACOLÓGICO
En contraste con el criterio prevaleciente en el decenio 1990-99, hoy se acepta que las intervenciones de tipo farmacológico deben quedar restringidas sólo a mujeres que tienen indicación específica para ello. Las contraindicaciones vigentes aplican a todas las formas de terapia hormonal, y se limitan a la presencia de cáncer de mama, uterino, o ambos, patología cardiovascular y hepática
martes, 18 de septiembre de 2018
HIPOTIROIDISMO
Tiroides hipoactiva.
Enfermedad autoinmune llamada tiroiditis de Hashimoto, en la que el sistema inmunitario ataca
y destruye el tejido tiroideo. Una presentación clínica frecuente de aquellos pacientes con cambios funcionales del sistema endocrino es la alteración de la función tiroidea. Ciertamente,
el hipotiroidismo subclínico representa el primer signo de una disfunción de hormonas tiroideas en muchas personas. Síntomas característicos son poca energía, manos y pies fríos, cansancio,
hipercolesterolemia, dolor muscular, depresión y alteraciones cognitivas. Es necesario evaluar el metabolismo de las hormonas tiroideas antes de iniciar el tratamiento con hormonas
tiroideas exógenas.
Las mujeres sufren hipotiroidismo con una frecuencia 5-8 veces mayor que la de los hombres. Además, las personas con enfermedad celíaca podrían estar en riesgo
Fisiopatología
La tiroiditis de Hashimoto es un trastorno autoinmune en el que el sistema inmunitario ataca y destruye la glándula tiroidea. Es la forma más frecuente de hipotiroidismo. La glándula tiroidea
agrandada y crónicamente inflamada deja de funcionar, y las partes reactivas de la glándula se deterioran tras unos años. Los autoanticuerpos tiroideos indican que el sistema inmunitario
está atacando al propio organismo y la presencia de un trastorno tiroideo autoinmune, ya sea hipertiroidismo o hipotiroidismo.
La tiroiditis de Hashimoto se diagnostica mediante análisis de anticuerpos específicos.
DESENCADENANTES
* estrès suprarrenal
* estrés oxidativo
* envejecimiento
*gestación
TRATAMIENTO MÉDICO
Tratamiento nutricional médico
Está bien establecida la participación de varios nutrientes en la salud tiroidea, especialmente yodo y selenio. Como el yodo tiene una función crítica en la síntesis de hormonas tiroideas, este oligoelemento mineral ha recibido históricamente más atención que ningún otro respecto a los trastornos tiroideos.
Otras deficiencias de micronutrientes como el hierro, el selenio, la vitamina A y posiblemente también el cinc podrían interaccionar con el estado nutricional del yodo y la función tiroidea (Hess, 2010).
DESENCADENANTES
* estrès suprarrenal
* estrés oxidativo
* envejecimiento
*gestación
TRATAMIENTO MÉDICO
Tratamiento nutricional médico
Está bien establecida la participación de varios nutrientes en la salud tiroidea, especialmente yodo y selenio. Como el yodo tiene una función crítica en la síntesis de hormonas tiroideas, este oligoelemento mineral ha recibido históricamente más atención que ningún otro respecto a los trastornos tiroideos.
Otras deficiencias de micronutrientes como el hierro, el selenio, la vitamina A y posiblemente también el cinc podrían interaccionar con el estado nutricional del yodo y la función tiroidea (Hess, 2010).
lunes, 17 de septiembre de 2018
SÍNDROME DE OVARIO POLIQUÍSTICO
El síndrome del ovario poliquístico es un trastorno endócrino frecuente, que afecta al 3-12% de las mujeres en edad reproductiva.
Se caracteriza por problemas ginecológicos como amenorrea y otras irregularidades menstruales, anovulación, ovarios grandes con múltiples quistes e infertilidad.
Otros síntomas generales son acné, hirsutismo (vello corporal excesivo o con una distribución anormal), calvicie de tipo masculino, obesidad y apnea del sueño.
FISIOPATOLOGÍA
- PRODUCCIÓN OVÁRICA DE ANDRÓGENOS.
La manifestación clínica más frecuente del SOP es el hirsutismo que resulta de un exceso de andrógenos circulantes, en su mayoría de origen ovárico.
- PRODUCCIÓN SUPRARRENAL DE ANDRÓGENOS
Hasta 40% de las pacientes con SOP producen andrógenos suprarrenales de manera excesiva, en particular sulfato de dehidroepiandrosterona (DHEA-s).
- RESISTENCIA A LA INSULINA
Distintos investigadores han demostrado que la mayoría de las pacientes con SOP, ya sean delgadas u obesas, cursan con resistencia la insulina (RI) e hiperinsulinemia.
Por último, se ha demostrado disfunción de la célula pancréatica y disminución en el aclaramiento de insulina.
- HIPERINSULINEMIA
La insulina juega un papel importante en la patogénesis del SOP, favoreciendo la producción de andrógenos ováricos y suprarrenales, de manera directa e indirecta, e inhibiendo la síntesis hepática de la globulina fijadora de hormonas sexuales.
- SECRECIÓN INAPROPIADA DE GONADOTROPINAS
El patrón de pulsatilidad de la GnRH determina en gran parte la proporción relativa de LH y FSH sintetizadas y secretadas por el gonadotropo. Un aumento en la frecuencia de los pulsos favorece la transcripción de la subunidad de la LH sobre la subunidad de la FSH, generando una mayor secreción de LH que de FSH. Esto se traduce en incremento de las concentraciones circulantes de LH, sin cambios o ligera disminución de la de hormona foliculoestimulante.
TRATAMIENTO DE LOS SÍNTOMAS
El tratamiento debe individualizarse en función del motivo de consulta, las características clínicas de la paciente y las comorbilidades. El tratamiento consiste en modificaciones en el estilo de vida, tratamiento farmacológico de las irregularidades menstruales, del exceso de andrógenos, de la infertilidad y de los trastornos metabólicos concurrentes.
Modificaciones en el estilo de vida
Las modificaciones en el estilo de vida son la piedra angular en las mujeres con sobrepeso u obesidad, ya que tienen como objetivo principal la reducción del peso. Sus efectos son de impacto metabólico y reproductivo, pero a pesar de que se ha asociado a disminución de las concentraciones de andrógenos, no tiene efecto significativo en la mejoría del hirsutismo. En estudios observacionales se ha descrito que la reducción de 5 a 10% del peso inicial se asocia a recuperación de los ciclos menstruales y a mejoría de las tasas de embarazo; sin embargo, no existen datos de estudios clínicos controlados que confirmen estas observaciones; tampoco algunos que muestren que estos efectos sean sostenidos a largo plazo.
TRATAMIENTO FARMACOLÓGICO
- Estrógenos y progestágenos
Los anticonceptivos combinados (AOC) que contienen 30 o 35 g de etinil-estradiol más una progestina, constituyen la primera opción para el tratamiento de alteraciones menstruales e hirsutismo. Su principal mecanismo de acción radica en la supresión de las gonadotropinas hipofisarias y el incremento de la SHBG, que conllevan a disminuir la producción de andrógenos de origen ovárico y la fracción de andrógenos libres.
Debido a las comorbilidades que pudieran existir, en cada caso deberá evaluarse si los AOC pueden administrarse en forma segura. Para este fin son útiles los criterios médicos de elegibilidad de la Organización Mundial de la Salud.
A pesar del efecto antiandrogénico que podrían tener algunas progestinas, no existe evidencia de superioridad de algunas formulaciones sobre otras en términos de sus efectos en hirsutismo, hiperandrogenemia o regularización de los ciclos. Esto incluye a la formulación más frecuentemente utilizada en pacientes con SOP, que contiene 35 g de etinilestradiol + 2 mg de acetato de
ciproterona (Diane®, Bayer; Eunice-35ED, Darier).
- Antiandrógenos
El uso de los antiandrógenos, como espironolactona, acetato de ciproterona, flutamida y finasteride como monoterapia, no se recomiendan para el tratamiento del hirsutismo en el SOP debido a sus potenciales efectos teratogénicos. Estos compuestos pueden usarse de manera conjunta con AOC, sin embargo, no han mostrado efecto aditivo al propio de la anticoncepción combinada.
- Sensibilizadores de insulina
El fármaco más empleado para el tratamiento del SOP es la metformina, no del todo apropiada, ya que se debe enfatizar que su uso debe limitarse a los casos en los que se corrobora que existe RI y alteraciones en el metabolismo de los carbohidratos, o ambos.
TRATAMIENTO NUTRICIONAL
Suscribirse a:
Comentarios (Atom)